已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H="+74.9" kJ·mol-1,下列说法中正确的是( )
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景的本质原因是
| A.空气中的小水滴颗粒直径大小介于10-9m~10-7m 之间 |
| B.光是一种胶体 |
| C.构成雾的小水滴是一种胶体 |
| D.发生丁达尔效应 |
化学与生产、生活、社会密切相关,下列有关说法正确的是
| A.腌制火腿时,添加少量NaNO2,是为了使火腿肉的味道更加美味可口 |
| B.溴化银是重要感光材料,可用于人工降雨 |
| C.任何元素的原子都是由核外电子和核内中子、质子组成的 |
| D.分类方法、定量研究、实验方法等是化学研究的常用方法 |
常温下用石墨作电极,电解100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,当阴极上生成的气体体积为1.12L时(标准状况),假设溶液体积不变,下列说法正确的是
| A.阳极上产生0.025mol的O2 |
| B.电解过程中总共转移0.2mol的电子 |
| C.所得溶液中的C(H+)=0.3mol/L |
| D.阴极增重1.08g |
有关下图及实验的描述不正确的是
| A.图1的实验可以测量大理石与盐酸的反应速率 |
| B.图2的实验说明吸热反应也可能是自发反应 |
| C.图3的两个电极都为铜片时,电解初期溶液的浓度基本不改变 |
| D.图4的实验中,铁钉上会有刺激性气体产生 |
下图是可逆反应A(g)+2B(g) 2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是:
2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是: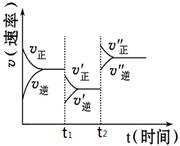
| A.t1时,减小了A或B的物质的量的浓度 |
| B.t2时,升高了温度 |
| C.t2时,增大了压强 |
| D.t1时,加了催化剂 |