下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是
| A.NaHCO3和Al(OH)3 | B.BaCl2和NaCl |
| C.KClO3和K2SO4 | D.Na2SO3和BaCO3 |
某温度下,在密闭容器中存在下列可逆反应:A(g)+2B(g) 
 4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
A.若为恒容容器,当a∶b∶c为2∶2∶1时,平衡不移动
B.若为恒容容器,当a∶b =9∶10,且c=0时,达平衡后,A、B、C物质的量之比仍为2∶2∶1
C.若为恒压容器,当a∶b为9∶10,c为任意值时,平衡后A的质量分数一定仍为w%
D.若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质 量分数小于w%
量分数小于w%
Li-I2 电池广泛用于笔记本电脑、摄像机等,下列有关锂电池工作原理的说法中不正确的是
| A.锂在反应中被还原 | B.该电池总反应式为:2Li+I2=2LiI |
| C.锂电池是一种高能电池 | D.正极的电极反应式为:I2+2e-=2I- |
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示: 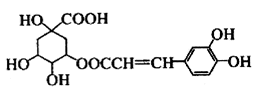
关于咖啡鞣酸的下列叙述正确的是
| A.与浓溴水能发生两种类型的反应 |
| B.1mol咖啡鞣酸可与含8mol NaOH的溶液反应 |
| C.分子式为C16H13O9 |
| D.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键 |
已知酸性: >H2CO3>
>H2CO3> ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将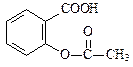 转变为
转变为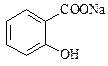 的最佳方法是
的最佳方法是
| A.与稀H2SO4共热后,加入足量NaOH溶液 |
| B.与稀H2SO4共热后,加入足量NaHCO3溶液 |
| C.与足量的NaOH溶液共热后,再通入足量CO2 |
| D.与足量的NaOH溶液共热后,再加入适量H2SO4 |
最近有人用一种称为“超酸”的化合物H (CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-.这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是
| A.Mg + 2HCl = MgCl2 + H2↑ | B.NaOH + HCl =" NaCl" + H2O |
| C.NH3 + HCl = NH4Cl | D.H2O +CH3COOH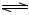 H3O+ +CH3COO- H3O+ +CH3COO- |