从下列事实,找出不能用勒沙特列原理解释的是
A.在溴水中存在如下平衡: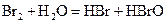 ,当加入NaOH溶液后颜色变浅 ,当加入NaOH溶液后颜色变浅 |
B.对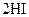   平衡体系增加压强使颜色变深 平衡体系增加压强使颜色变深 |
C.反应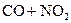  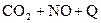 升高温度使平衡向逆方向移动 升高温度使平衡向逆方向移动 |
D.合成氨反应: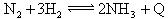 ,为使氨的产率提高,理论上应采取低温高压的措施 ,为使氨的产率提高,理论上应采取低温高压的措施 |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(B2)=1.2 mol·L-1·s-1 |
下列说法或表示方法中正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH=" -1.9KJ/mol" 可知,金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| D.向纯水中加入硫酸氢钠,水的电离程度减小,Kw值不变。 |
从下列事实所得出的解释或结论正确的是
| 选项 |
实验事实 |
解释或结论 |
| A |
2N2O5(g)=4NO2(g)+O2(g) ΔH>0 在室温下能自发进行 |
这是一个熵增的反应 |
| B |
压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 |
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C |
锌与稀硫酸反应过程中,开始反应后,速率逐渐增大 |
该反应是吸热反应 |
| D |
已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 |
反应物的浓度一定降低 |
对于可逆反应A(g)+2B(g) 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是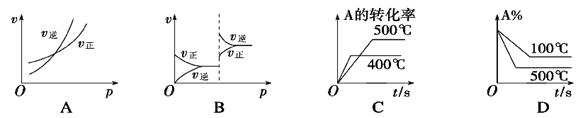
在恒温、恒容条件下,能使A(g)+B(g)  C(g)+D(g)正反应速率增大的措施是
C(g)+D(g)正反应速率增大的措施是
| A.减小C或D的浓度 | B.增大D的浓度 |
| C.减小B的浓度 | D.增大A或B的浓度 |