可逆反应N2+3H2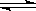 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A 3v正(N2)=v正(H2) B v正(N2)=v逆(NH3)
C 2v正(H2)=3v逆(NH3) D v正(N2)=3v逆(H2)
有一种无色的混合气体可能由CH4、NH3、、H2、CO、CO2和HCl组成。为确定其组成,依次进行了以下实验:①将此混合气体通过浓硫酸,气体总体积基本不变。②再通过过量的澄清石灰水,未见浑浊,但气体体积减少。③把剩余气体在供氧的情况下燃烧,燃烧产物不能使无水硫酸铜变色。原混合气体一定含有
| A.CO和HCl | B.CH4和NH3 | C.CH4和HCl | D.H2和CO2 |
钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是
| A.反应①、②中消耗等量的O2转移电子数目相等 |
| B.反应①发生电化学腐蚀O2被氧化作正极 |
| C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32—+O2+xOH—=Fe3O4+S4O62— +2H2O,下列说法正确的是
| A.x=2 |
| B.参加反应的Fe2+全部做还原剂 |
| C.每生成1mol Fe3O4,反应转移的电子总数为4mol |
| D.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
下列变化属于吸热反应的是:
①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气
⑤生石灰与水反应生成熟石灰⑤I2→I+I⑥H+Cl→HCl⑦氢气还原氧化铜
| A.①②④⑤ | B.②④⑤⑦ | C.①④⑤③ | D.②④⑦ |
在一个不传热的固定容积的密闭容器中,可逆反应: N2+3H2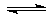 2NH3 ,达到平衡的标志是
2NH3 ,达到平衡的标志是
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2②各组分的物质的 量浓度不再改变
量浓度不再改变
③体系的压强不再发生变化④混合气体的密度不变
⑤体系的温度不再发生变化⑥ 2V(N2)正= V(NH3)
⑦单位时间内3 mol H—H断键反应同时2 mol N—H也断键反应
| A.①、②、③、⑤、⑥ | B.②、③、⑤、⑥ |
| C.②、③、⑤、⑥、⑦ | D.②、③、④、⑥、⑦ |