有一定质量的镁铝合金,将其平均分成两份。第一份加入到100m L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?②
L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?② 盐酸的质量分数是多少?
盐酸的质量分数是多少?
在容积为2.0 L的密闭容器中充入0.60 mol X和1.60 mol Y,发生反应:
aX(g)+3Y(g)  2Z(g)
2Z(g)
经过10 min反应达到平衡状态,Y的浓度为0.2 mol/L,Z的物质的量分数为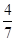 。
。
计算:① 10min内,Z的平均反应速率;
② a 的值;
③ 该条件下X的平衡转化率(百分数表示,保留一位小数);
④该条件下反应2Z(g)  aX(g)+3Y(g)的平衡常数。
aX(g)+3Y(g)的平衡常数。
将1molH2和1molI2(g)加入2L密闭容器中进行反应:H2 + I2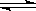 2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求
2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求
(1)用氢气的浓度变化来表示2min内的该反应的平均速率?
(2)2min末I2(g)的物质的量浓度?
0.2mol某有机物和0.2mol O2在密闭容器中恰好完全反应,生成CO2、CO和H2O。将该混合气体依次通过浓硫酸、灼热的CuO和碱石灰后(假设每一步均充分反应),浓硫酸增重7.2g,CuO固体质量减少3.2g,而碱石灰增重17.6g。(
⑴产物的物质的量为:n(H2O)=mol,n(CO)=mol,n(CO2)=mol。
⑵该有机物的分子式为。
⑶等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,则该有机物的结构简式为
“鸟语花香”是环境美的标志之一;乙酸乙酯是一种香料,用92g乙醇、30g乙酸和40g浓硫酸均匀混合,在一定温度下充分反应,如果实际产率是理论产率的50℅;
(1)通过计算确定可得到的乙酸乙酯的质量
(2)通过计算确定反应后的混合物中水的质量分数(不考虑物质挥发)
(3)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,若不考虑反应物的挥发,理论上能否生成1mol乙酸乙酯?(填能或不能),原因是。
(6分)在标准状况下,将11.2L乙烯和乙烷的混合气体缓慢的通入足量的溴水中,充分反应后,溴水的质量增加了5.6g(不考虑物质挥发);
(1)写出有关反应的化学方程式
(2)通过计算确定原气体混合物中乙烯与乙烷气体的物质的量之比和质量比