用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如右图所示。根据分析、判断,正确的是 ( )
| A. OE段表示的反应速率最快 |
| B. EF段表示的反应速率最快,收集的CO2最多 |
| C. FG段收集的CO2最多 |
| D. OG段表示随着时间的推移,反应速率逐渐增快 |
区别强弱电解质的标准是( )
| A.化合物水溶液的导电性 |
| B.在水中化合物的溶解度 |
| C.化合物在水溶液中的电离程度 |
| D.化合物溶于水后是否与水反应生成能电离的物质 |
下列变化需加入还原剂才能实现的是( )
A.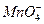 →Mn2+ →Mn2+ |
B.Cu→Cu2+ |
| C.Cl-→Cl2 | D.H2S→SO2 |
在8NH3+3Cl2====6NH4Cl+N2反应中,氧化产物与还原产物的分子个数比为( )
| A.8∶3 | B.3∶8 | C.6∶1 | D.1∶6 |
下列离子方程式正确的是( )
A.碳酸氢铵溶液与足量氢氧化钠溶液反应: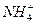 +OH-====NH3·H2O +OH-====NH3·H2O |
| B.Fe(OH)3与氢碘酸溶液混合:Fe(OH)3+3H+====Fe3++3H2O |
| C.电解精炼铜的阴极反应是:Cu2++2e-====Cu |
D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl等体积互相均匀混合:2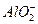 +5H+====Al(OH)3↓+Al3++H2O +5H+====Al(OH)3↓+Al3++H2O |
反应2FeCl3+H2S====2FeCl2+S↓+2HCl改写为离子方程式,正确的是( )
| A.2Fe3++S2-====2Fe2++S↓ | B.Fe3++H2S====Fe2++S↓+2H+ |
| C.2Fe3++H2S====Fe2++S↓+2H+ | D.2FeCl3+S2-====2FeCl2+S↓+2Cl- |