已知某化学反应的平衡常数表达式为K=,在不同的温度下该反应的平衡常数值分别为:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式:=,判断此时的温度是1000 ℃
对于反应N2 (g) + 3H2 (g) 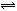 2NH3 (g) 来说,以下化学反应速率的表示中,反应速率最快的是()
2NH3 (g) 来说,以下化学反应速率的表示中,反应速率最快的是()
| A.v(H2) =0.8mol/(L•s) | B.v(N2) =0.4mol/(L•s) |
| C.v(NH3) =0.6mol/(L•s) | D.v(H2) =4.2mol/(L•min) |
把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,
已知U形管内预先装有少量水(为使水容易观察,预先染成红色),如图所示,结果U形管左边液面升高,则加入的物质可能是()
| A.NaOH固体 | B.NH4NO3晶体 |
| C.浓H2SO4 | D.Na2O2固体 |
元素R的质量数为A,Rn- 的核外电子数为x,则w g Rn- 所含中子的物质的量为
| A.(A-x+n) mol | B.(A-x-n) mol | C.(A-x+n) mol | D.(A-x-n) mol |
下列各组中化合物的性质比较,不正确的是()
| A.酸性:HClO4>HBrO4>HIO4 | B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.稳定性:PH3>H2S> HCl | D.非金属性:F>O>S |
下列有关原子结构和元素周期律表述正确的是()
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |