用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 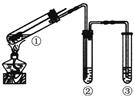
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,再加入50 mL0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:
“FeSO4 +KNO3 + H2SO4= K2SO4 +Fe2(SO4)3+NxOy + H2O”,则对该反应的下列说法正确的是
| A.反应中还原产物是NO |
| B.氧化产物和还原产物的物质的量之比为1∶4 |
| C.反应过程中转移的电子数为8e- |
| D.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是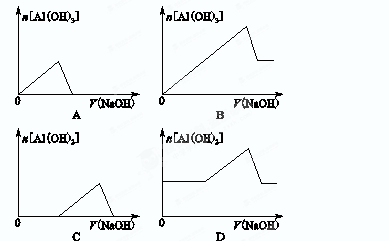
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.三者对应的氧化物均能溶于水 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
下列表示对应化学反应的离子方程式正确的是
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-===Ag++NO↑+H2O |
下列解释实验现象的反应方程式正确的是
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2==Na2O2 |
| B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-==Ag2S↓+2Cl- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2===2Na2CO3+O2 |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O |