离子方程式H++OH-=H2O可表示的化学反应是
| A.盐酸和氢氧化钡的反应 |
| B.硝酸和氢氧化镁的反应 |
| C.硫酸和氢氧化钡的反应 |
| D.盐酸和氢氧化铜反应 |
反应4NH3+5O2 4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为
A. (O2)=0.01 mol·L-1·s-1 (O2)=0.01 mol·L-1·s-1 |
B. (NO)=0.008 mol·L-1·s-1 (NO)=0.008 mol·L-1·s-1 |
C. (H2O)=0.003 mol·L-1·s-1 (H2O)=0.003 mol·L-1·s-1 |
D. (NH3)=0.002 mol·L-1·s-1 (NH3)=0.002 mol·L-1·s-1 |
反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。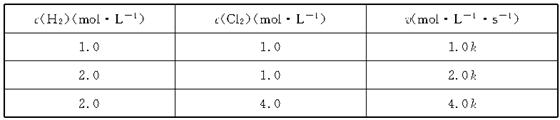
由此可推得,m、n值正确的是
| A.m=1,n="1" | B.m=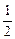 ,n= ,n=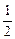 |
C.m=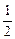 ,n="1" ,n="1" |
D.m=1,n=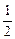 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)
2C(g)
若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
对某一可逆反应来说,使用催化剂的作用是
| A.提高反应物的平衡转化率 |
| B.以同样程度改变正逆反应的速率 |
| C.增大正反应速率,减小逆反应速率 |
| D.改变平衡混合物的组成 |
设C+CO2 2CO-Q1,反应速率为v1;N2+3H2
2CO-Q1,反应速率为v1;N2+3H2 2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |