下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。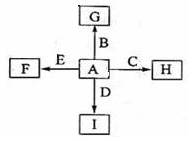
回答问题:
⑴①中反应的化学方程式为 ;
⑵化合物I的电子式为 ,它的空间结构是 ;
⑶1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少所需的铜粉的质量为 ,
⑷C与过量NaOH溶液反应的离子方程为 ,反应后的溶液与过量化合物I反应的离子方程式为 ;
⑸E在I中燃烧观察到的现象是 。
⑹G的化学式是 。
配制500 mL 1 mol·L-1 NaCl溶液时,下列操作会使实验结果偏高的是______________,偏低的是______________,无影响的是______________。
| A.振荡、摇匀溶液后,发现液面低于刻度线,再补加水 |
| B.称量时,固体放在右盘,砝码放在左盘(未用游码) |
| C.原容量瓶洗涤后未干燥 |
| D.移液时,未洗涤烧杯和玻璃棒 |
E.定容时,俯视刻度线
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率υA=__________,υB=_____________,υC=___________。该反应的化学反应方程式为 。
如图所示,合成氨反应:N2(g)+3H2(g) 2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
列问题:
⑴合成氨反应已达平衡状态的时间段为:。
⑵t1~t2时间段是改变的条件使平衡向方向移动;t4~t5时间段是改变的条件使平衡向方向移动。
⑶在此过程中,氨的百分含量最高的一段时间是。
在某温度下,A+B 2C反应达到化学平衡。
2C反应达到化学平衡。
(1)升高温度时,C的物质的量浓度减小,则正反应是 热反应,υ(正) ,
υ(逆) (“减慢”或“加快”),平衡向 移动。
(2)若B为气态,增大压强平衡不发生移动,则A是 态,C是 态。
(3)若增减B的量,平衡不发生移动,则B是 态。
将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)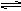 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(H2)= ,υ(I2)= 。
(2)2min未[HI]= mol/L。
(3)起始时,[H2]= mol/L,[I2]= mol/L。