下列电离方程式错误的是 ( )
A.H2CO3 2H+ +CO32- 2H+ +CO32- |
B. NaHSO4(溶液)=Na++H++SO42- |
| C.NaHCO3=Na++HCO3- | D. Ba (OH)2=Ba2++2OH- |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.0.2 mol H2O2完全分解转移的电子数为0.4 NA |
| B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA |
| C.在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA |
| D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA |
化学与生活、社会密切相关。下列说法正确的是
| A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2 |
| B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
| C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 |
| D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.11.2 L氧气中所含有的原子数为NA |
| B.7.8g的Na2O2中含有的阴离子的数目为0.2NA |
| C.0.10 mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10 NA |
| D.54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是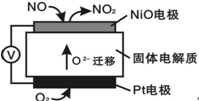
| A.该装置实现化学能向电能的转化 |
| B.该电池的总反应为2NO + O2 = 2NO2 |
| C.NiO电极的电极反应式: NO + O2- - 2e—= NO2 |
| D.当有2.24L的O2参与反应时,转移了0.4mole— |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
| A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B.l mol C22H46中含有的C—C键个数约为21×6.02×1023 |
| C.0.1mol 24Mg32S晶体中所含中子总数为28×6.02×1023 |
| D.1 mol Na2O2中所含的阴离子数约为2×6.02×1023 |