下列说法正确的是
A.常温下0.4 mol/L HB溶液和0. 2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
下列说法不正确的是( )
| A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行 |
B.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
下列叙述中正确的是( )
①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率;
②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀;
③电镀时,应把镀件置于电解槽的阴极;
④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解;
⑤钢铁表面常易锈蚀生成Fe2O3·nH2O。
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.②④ |
把锌片和铁片放在盛有稀食盐水和酚酞溶液的表面皿中,如下图所示。最先观察到酚酞变红现象的区域是( )
| A.Ⅰ和Ⅲ | B.Ⅰ和Ⅳ | C.Ⅱ和Ⅲ | D.Ⅱ和Ⅳ |
如下图所示装置中都盛有0.1 mol·L-1的NaCl溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是( )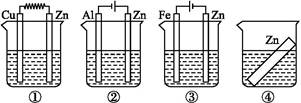
| A.③①④② | B.①②④③ | C.①②③④ | D.②①④③ |