(8分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________,滴定终点的判断方法是________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是 .
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL.
元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布。下列推测不正确的是
| A.同周期元素中X的金属性最强 |
| B.原子半径:X>Y,离子半径:X+>Z2- |
| C.同族元素中Z的氢化物稳定性最高 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
如图是元素周期表的一部分,下列说法中正确的是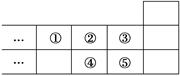
| A.元素①位于第2周期第ⅣA族 |
| B.气态氢化物的稳定性:④>② |
| C.最高价氧化物对应水化物的酸性:⑤>④ |
| D.元素的最高正化合价:③=⑤ |
下列各组元素性质递变情况错误的是
A.B、C、N、O、F原子半径依次增大
B.P、S、Cl元素最高正化合价依次升高
C.H、Be、B原子最外层电子数依次增多
D.Li、Na、K、Rb的金属性依次增强
已知硒是元素周期表中第四周期第ⅥA族元素,关于硒的性质判断肯定不正确的
| A.硒的含氧化合物以Se2O3形式存在 |
| B.硒的含氢化合物以H2Se形式存在 |
| C.硒的氢化物的稳定性比硫化氢差 |
| D.硒的最高价氧化物对应水化物的化学式是H2SeO4 |
下列比较错误的是
| A.金属性:Na>Mg>Al |
| B.非金属性:Cl>S>P>Si |
| C.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D.酸性:HClO>H2SO3>H3PO4>H4SiO4 |