高氯酸是很强的酸,沸点是130℃。质量分数为60%的溶液加热不分解,浓度增高就不稳定,受热易分解,热、浓的高氯酸溶液遇有机物爆炸。为使市售的70%高氯酸进一步浓缩,所采取的措施正确的是
| A.各仪器连接处必须用磨口玻璃 | B.各仪器连接处的橡胶塞应塞紧防止漏气 |
| C.加入生石灰后减压蒸馏 | D.加入浓硫酸后常压蒸馏 |
下列关于氯的说法正确的是()
| A.氯气具有很强的氧化性,在化学反应中只能作氧化剂 |
| B.35 17Cl、37 17Cl为氯元素不同的核素,具有不同的化学性质 |
| C.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟雾 |
| D.氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
在18世纪70年代,首先发现并制得氯气的化学家是()
| A.戴维 | B.舍勒 | C.维勒 | D.道尔顿 |
下列除去杂质的方法正确的是
| A.除去CO2中混有的CO:将混合气体通过装有NaOH溶液的洗气瓶 |
| B.除去铜器表面的铜绿:用稀硝酸浸泡,再用水冲洗 |
| C.除去KNO3溶液中少量NaCl:加水溶解,蒸发结晶,趁热过滤 |
| D.除去Mg(OH)2固体中少量Ca(OH)2:加入足量MgCl2溶液,充分搅拌后过滤 |
为确定某溶液的离子组成,进行如下实验:①测定溶液的pH ,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。④取上层清液继续加Ba(NO3)2溶液至无沉淀时,再加AgNO3溶液,产生白色沉淀。根据实验,以下推测正确的是
,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。④取上层清液继续加Ba(NO3)2溶液至无沉淀时,再加AgNO3溶液,产生白色沉淀。根据实验,以下推测正确的是
| A.一定有SO32-- | B.一定有CO32-- |
C.一定有C 1-- 1-- |
D.不能确定是否存在HCO3-- |
对实验Ⅰ~Ⅳ的实验现象预测正确的是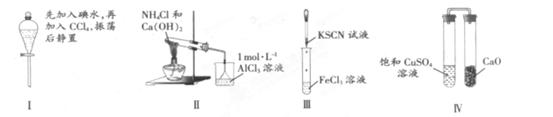
| A.实验Ⅰ:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先后出现白色沉淀,后溶解 |
| C.实验III:试管中生成红色沉淀 |
| D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |