某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验: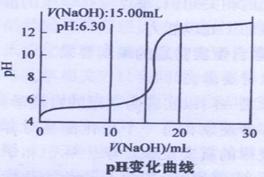
①分别配置50mL物质的量浓度均为0.100mol/L的CuSO4溶液和NaOH溶液;
②准确量取10mL CuSO4溶液倒入50ml烧杯中
③向烧杯中匀速加入0.100 mol/L的NaOH溶液,并每加入1.00mlNaOH溶液用pH计测一次混合溶液的pH
④当滴入NaOH溶液的体积达到30ml时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时PH变化曲线。如右图
请回答下列问题:
(1)配置溶液时需要使用烧杯、 、 等玻璃仪器;下列仪器中可用于向烧杯中加入NaOH溶液的仪器是
| A.胶头滴管 | B.酸式滴定管 | C.碱式滴定管 | D.量筒 |
(2)V(NaOH)在2.00ml~15.00ml之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜。当V(NaOH)为15.00ml时,溶液PH为6.32(已知蒸馏水的PH为6.32),则可求得x= y=
(3)V(NaOH)在17.00ml~20.00ml之间时,溶液中出现蓝色沉淀,并不断增加。已知V(NaOH)为20.00ml时,溶液PH为12.25,则此时沉淀中 (填“含”或“不含”)有碱式硫酸铜,请设计实验方案加以证明:
A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原子半径最小的元素,B、C左右相邻,C、D位于同主族.
(1)E元素原子的结构示意图为:,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:.
(2)A与C组成的化合物的电子式为,其中含有的化学键为(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
(3)A、B、C、D四种元素中的三种能组成一种强酸,该强酸的稀溶液能与铜反应,其中起氧化性作用的酸占消耗酸总物质的量的百分比是.
(4)由A、B、C、D四种元素组成的一种离子化合物X.
①已知1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下X与NaOH浓溶液反应的离子方程式:.
②又知X既能与盐酸反应,又能与氯水反应,写出X的化学式:.
(9分)
(1)请用下列10种物质的序号填空:①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是______________________________________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
| A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
(9分)
(1)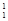 H、
H、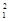 H、
H、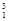 H互为________,16O2、18O3互为________。
H互为________,16O2、18O3互为________。
| A.同位素 | B.相同物质 |
| C.同素异形体 | D.同分异构体 |
(2)某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的相对原子量约为________,R元素周期表中的位置为________________。
(3)铷和另一种碱金属形成的合金7.8 g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:________________。(铷的相对原子量取85.5)
(4)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为________。
(12分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。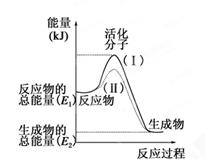
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将______转化为________。
(3)50mL 0.50mol•L﹣1盐酸与50mL 0.55mol•L﹣1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题: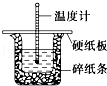
①从实验装置上看,图中尚缺少的一种玻璃用品是.
②烧杯间填满碎纸条的作用是.
③大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
④实验中改用60mL 0.50mol•L﹣1盐酸跟50 mL 0.55mol•L﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由:。
⑤用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(均填“偏大”、“偏小”或“无影响”)
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:___________。
(2)周期表中位于第8纵行的铁元素属于第族。
(3)周期表中最活泼的非金属元素位于第纵行。
(4)所含元素超过18种的周期是第、周期
(5)请写出298K,101KPa时,下列反应的热化学方程式:
用CO(g)还原1mol Fe2O3(s)放热24.8KJ 。