过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:
①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液; ④滴入稀盐酸至溶液呈中性; ⑤过滤
(1)下列操作顺序正确的是
| A.③②①⑤④ | B.①②③⑤④ | C.②③①⑤④ | D.③⑤②①④ |
 (2)如何用实验方法确定①中Na2CO3溶液已过量?
(2)如何用实验方法确定①中Na2CO3溶液已过量?
(3)若④和⑤两步操作反了可能造成什么后果?
。
(4)滴入稀盐酸至溶液呈中性涉及到的离子反应方程式
(1)已知1mol葡萄糖完全燃烧放热2800kJ。写出葡萄糖燃烧的化学反应方程式:___________________________________________________。现有72g葡萄糖(C6H12O6)与足量的氧气充分反应,共放热______________kJ。
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示(电解质溶液为酸性),试写出该电池的两极反应式:_______________________________________________________质子在交换膜上向_________(填正或负)极区迁移。72g葡萄糖在该电池中可转移电子__________mol。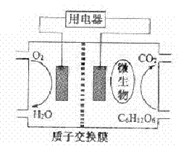
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)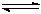
CH3OH(g)。图1表示反应进行过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂),图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。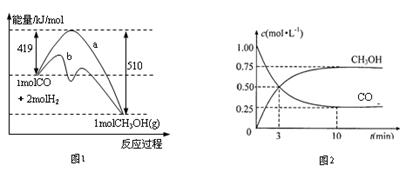
(1)下列说法正确的是______________
| A.反应进行到3min时达到化学平衡状态 |
| B.是否使用催化剂对反应前后的能量变化没有影响 |
| C.当反应物消耗量一定时,若反应生成液态甲醇,能量变化值会更大 |
| D.平衡时氢气的浓度为1mol/L |
(2)从反应开始到平衡状态,用CO浓度变化表示的反应速率为_______________,H2的转化率为______________。
(3)当有0.25mol CH3OH生成时会__________(填吸收或放出)___________kJ的热量。
已知X、Y、Z、W四种元素是元素周期表中三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。试推断:
(1)X、Y、Z、W四种元素的符号:X、Y、Z、W。元素Z在周期表中的位置是______________________。
(2)由以上元素中的两种元素组成的化合物,溶于水后水溶液显碱性,该化合物的电子式分别为、(任写2种)。
(3)由X、Y、Z所形成的共价化合物(Y呈最高价)是,离子化合物是。(均写化学式)
(4)由X和Y两种元素组成的18电子的分子为__________(写分子式),该分子中所有原子都已达到类似于稀有气体原子的稳定结构,则其结构式为__________。
(1)同一短周期元素的电子层数__________,但随着原子序数的递增,最外层电子数逐渐__________、原子半径逐渐___________,因此失电子能力逐渐__________,得电子能力逐渐_________,所以元素的金属性逐渐___________,非金属性逐渐___________。第三周期非金属元素的最高价氧化物的水化物酸性由强到弱的顺序是________________________________________。
(2)日常生活中用于减缓食物腐败变质的措施和方法有__________________________、
________________________________、____________________________________等。
A. A、B、C、D、E、F为原子序数依次增大的短周期主族元素。 A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
⑴写出B的基态原子的核外电子排布式。
⑵A、C形成的最简单分子极易溶于水,其主要原因是;与该最简单分子互为等电子体的阳离子为。
⑶比较E、F的第一电离能:EF(选填“>”或“<”)。
⑷BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为。
⑸光谱证实单质F与强碱性溶液反应有[F(OH)4]—生成,则[F(OH)4]—中存在。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
B.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是。
⑵设计方案如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式:。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
。
⑹实验优化学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是。
②从环境保护的角度,请你再提出一个优化方案:。