NA表示阿佛加德罗常数。下列说法中正确的是
| A.200mLl.00mol·L-lFe2(SO4)3,溶液中,Fe3+和SO42-离子数的总和是NA |
| B.O2和O3的混合物共4.8 g,其中所含氧原子数为0.3 NA |
C.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转 移电子数为2 移电子数为2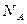 个 个 |
| D.标准状况下,22.4 L NO和11.2 L O2混合后气体的分子总数为1.5 NA |
对I~IV的实验操作现象判断正确的是
| A.实验I:产生红褐色沉淀 |
| B.实验II:溶液颜色变红 |
| C.实验III:放出大量气体 |
| D.实验IV:先出现白色沉淀,后沉淀又溶解 |
与100mL0.1 mol·L—1AlCl3溶液中Cl—的物质的量浓度相等的是
| A.50mL0.1 mol·L—1NaCl溶液 | B.50mL0.15 mol·L—1MgCl2溶液 |
| C.10mL1.0 mol·L—1FeCl3溶液 | D.100mL0.3 mol·L—1 KClO3溶液 |
“神舟八号”飞船成功发射升空,开启了与“天宫一号”交会对接之旅。下列物质在一定条件下均可产生氧气,其中能用在宇航员呼吸面具中提供氧气的物质是
| A.KMnO4 | B.Na2O2 | C.KClO3 | D.H2O2 |
纳米科技是21世纪经济发展的发动机。人们会利用纳米级(1—100 nm,1 nm=10-9 m)粒子物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用。下列分散系与纳米级粒子在直径上具有相同数量级的是
| A.溶液 | B.胶体 | C.悬浊液 | D.乳浊液 |
酸雨有很大的危害。下列气体在空气中达到一定含量时,可形成酸雨的是
| A.NH3 | B.CO | C.SO2 | D.H2 |