某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中 Cu的物质的量分数为a ,将其全部投入100mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。当溶液中金属离子只有Fe3+、Cu2+时,则a与b的
Cu的物质的量分数为a ,将其全部投入100mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。当溶液中金属离子只有Fe3+、Cu2+时,则a与b的 关系为:
关系为:
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
| A.n(烧碱)<n(稀硝酸)<n(盐酸) |
| B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(稀硝酸)<n(烧碱)<n(盐酸) |
| D.n(盐酸)<n(稀硝酸)<n(烧碱) |
下列根据实验操作和现象所得出的结论正确的是:
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向溶液中滴加盐酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中不一定含有SO42- |
| B |
向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 |
试纸不变蓝 |
原溶液中无NH4+ |
| C |
向PbO2中滴入浓盐酸 |
有黄绿色气体 |
PbO2具有氧化性 |
| D |
向溶液X中加入稀盐酸,并将产生的 无色气体通入澄清石灰水中 |
有白色沉淀生成 |
溶液X中一定含有CO32- |
下列因果关系叙述正确的是
| A.SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18mol/L的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2;④过量铜与浓硫酸;
⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石
| A.②③④⑥ | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
用图中所示的装置进行实验,实验现象与预测不一致的是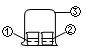
| ①中的物质 |
②中的物质 |
预测现象 |
|
| A |
浓氨水 |
FeCl3溶液 |
②中有红褐色沉淀 |
| B |
浓氨水 |
浓盐酸 |
③中有白烟 |
| C |
浓硝酸 |
淀粉KI溶液 |
②中溶液变为蓝色 |
| D |
饱和亚硫酸 |
蓝色石蕊试液 |
②中溶液先变红色又褪色 |