常温下用石墨电极电解1L 0.01 mol·L-1NaCl溶液,电解一段时间后,阴极产生0.04g气体。下列说法正确的是(假设电解过程中溶液体积不变)
| A.电解过程中有0.02mol电子转移 |
| B.阳极产物只有氯气 |
| C.在标准状况下,阳极产生的气体体积为0.448L |
| D.电解后溶液的pH =12 |
常温下,下列离子浓度的关系正确的是
| A.pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| B.0.2 mol·L-1的CH3COONa溶液与0.1 mol·L-1的HCl等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| C.0.1 mol·L-1的HCN(弱酸)和0.1 mol·L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+) |
| D.相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O |
室温时将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
| A.若pH>7,则一定是c1V1=c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c1<c2 |
| D.若V1=V2、c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol· L-1的一元酸HA与b mol· L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,[H+]=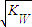 mol·L·-1 mol·L·-1 |
| D.混合溶液中,c(H+)+c(B+)===c(OH-)+c(A-) |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
25℃时,在等体积的①pH=0的H2SO4溶液
②0.05 mol·L-1的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |