有两个密闭容器A和B,A容器内有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。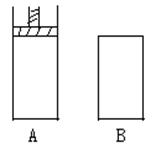
起始时向这两个容器中分别充入等量的体积比为2:1的SO2和O2的混合气体,并使A和B的容积相等。在保持4000C的条件下使之发生如下反应:2 SO2+O2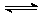 2SO3。
2SO3。
(1)达到平衡时所需要的时间A容器比B容器 ,A容器中SO2的转化率比B容器 。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡 移动,B容器化学平衡 移动。
移动。
(3 )达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器SO3物质的量分数 ;B容器中SO3的物质的量分数 。(填增大、减小、不变)
)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器SO3物质的量分数 ;B容器中SO3的物质的量分数 。(填增大、减小、不变)
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国 家的石油化工发展水平,A还是一 种植物生长调节剂,A可发生如图所示的一系列化学反应, 其中①②③属于同种反应类型。根据如图回答下列问题: 
(1)写出D、E的结构简式:
D, E 。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
② 、反应类型。
⑤ 、反应类型。
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系: Cr2O72- + H2O 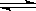 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈____色,因为。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈色, 因为。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡,溶液颜色将。
已知:H+(aq)+OH-(aq)= H2O(l)ΔH="-57.3" kJ/ mol,计算下列中和反应中放出的热量:
(1)用20 g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出kJ的热量。
(2)用0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反应,能放出kJ的热量。
(3)用1 mol醋酸稀溶液和足量NaOH稀溶液反应,放出的热量(填“大于”、“小于”或“等于”)57.3 kJ,理由是。
(4)1 L 0.1 mol/L NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为。
Ⅰ.有机物A的结构简式如图所示:
(1)A与过量NaOH完全反应时,A与参加反应的NaOH的物质的量之比为_________________。
(2)A与新制Cu(OH)2完全反应时,其中A与被还原的Cu(OH)2的物质的量之比为_________________。
(3)A与过量的NaHCO3完全反应时,A与参加反应的NaHCO3物质的量之比为_________________。
Ⅱ.以乙烯为原料可以通过下图所示路线合成E和H(部分反应条件已略去):
(1)A中含有的官能团名称为_________________。
(2)G和乙酸反应生成H的反应类型为_________________;C转化为D的反应类型是_________________。
(3)写出D与足量NaOH溶液完全反应的化学方程式_________________。
(4)F的结构简式为_________________,H的结构简式为_________________;
(5)写出同时满足下列条件的B的一种同分异构体的结构简式_________________。
A. 能发生银镜反应
B. 核磁共振氢谱只有4个峰
C. 能与FeCl3溶液发生显色反应,水解时每mol可消耗3molNaOH
Ⅰ下列描述中正确的是()
| A.CS2为V形的极性分子 |
B. 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有6对完全相同的成键电子对 |
D.SiF4和 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
Ⅱ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为__________________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同, 和
和 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________;
(5)丁二酮肟常用于检验 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________;
②该结构中,氧氢之间除共价键外还可存在_________________键;
③该结构中,碳原子的杂化轨道类型有_________________。