镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiO(OH) + 2H2O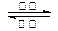
 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
| A.充电时阳极反应:Ni(OH)2 + OH- -e-="=" NiO(OH )+ H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
以下关于甲烷的说法中错误的是
| A.甲烷分子具有正四面体结构 |
| B.甲烷化学性质比较稳定,不被任何氧化剂氧化 |
| C.甲烷分子中具有极性键 |
| D.甲烷分子中四个C—H键是完全等价的键 |
下列说法正确的是
| A.物质发生化学反应都伴随着能量变化 |
| B.伴有能量变化的物质变化都是化学变化 |
| C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
| D.放热反应的发生无需任何条件 |
在周期表中,金属元素和非金属元素的分界线附近能找到
| A.制农药的元素 | B.制催化剂的元素 |
| C.制耐高温合金材料的元素 | D.制半导体的元素 |
下列物质中,只含有离子键,不含有共价键的是
| A.HCl | B.KOH | C.CaCl2 | D.CO2 |
对于可逆反应N2(g)+3H2(g)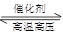 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.υ(H2)=0.3mol/(L·min) | B.υ(N2)=0.2mol/(L·min) |
| C.υ(NH3)=0.25mol/(L·min) | D.υ(H2)=0.4mol/(L·min) |