2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他 对固体表面化学研究过程中的重大发现.使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
对固体表面化学研究过程中的重大发现.使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
| A.CO在铂表面被氧化生成CO2,铂起催化作用 |
| B.汽车尾气中NOx在铂表面发生反应的产物是N2 |
| C.CO在铂表面可能和O2、NOx反应 |
| D.NOx、CO、CO2均能与人体中的血红蛋白结合 |
下列叙述不正确的是()
A.用电子式表示HCl的形成过程: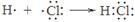 |
B.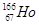 中的原子核内的中子数与核外电子数之差是99 中的原子核内的中子数与核外电子数之差是99 |
C.在空气中加热金属锂:4Li + O2 2Li2O 2Li2O |
D.铝热法炼铁:2Al + Fe2O3 2Fe+ Al2O3 2Fe+ Al2O3 |
下列叙述不正确的是()
| A |
B |
C |
D |
 |
 |
  |
 |
| 闪电时会发生反应: N2 + O2  2NO 2NO |
利用丁达尔效应证明烧杯中的分散系是胶体 |
蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 |
加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
NA为阿伏加德罗常数的数值,下列说法中正确的是()
| A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA |
| B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
| C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
化学在生产和日常生活中有着重要的应用。下列说法正确是()
| A.高纯度的硅单质广泛用于制作光导纤维 |
| B.向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染 |
| C.将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管 |
| D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
下列实验装置设计正确、且能达到目的的是( )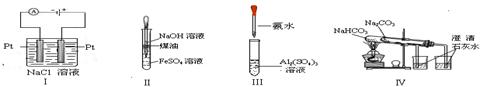
| A.实验Ⅰ:制备金属钠 | B.实验Ⅱ:制取氢氧化亚铁并观察其颜色 |
| C.实验Ⅲ:制取少量的氢氧化铝 | D.实验Ⅳ:比较两种物质的热稳定性 |