实验室欲用碳酸钠固体配制500mL、0.10mol·L-1的Na2CO3溶液,下列叙述正确的是
A.实验 用到的仪器有:托盘天平、烧杯、500mL容量瓶、玻璃棒 用到的仪器有:托盘天平、烧杯、500mL容量瓶、玻璃棒 |
| B.将称量好的固体放入500mL容量瓶中溶解 |
| C.定容时若俯视刻度,则所得溶液浓度偏高 |
| D.定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
| A.C(s)+1/2O2(g)=CO(g) △H =" -" 393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l) △H =" +" 571.6 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =" -" 890.3 kJ/mol |
| D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H =" -" 2800 kJ/mol |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH =-192.9 kJ/mol
下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ/mol |
B.反应①中的能量变化如图所示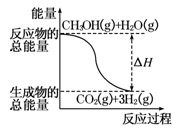 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
5月3日,广东省发现部分患者使用了齐齐哈尔第二制药有限公司生产的“亮菌甲素注射液”后,出现了严重不良反应,并有多人死亡。目前这起假药案的成因已经水落石出:该公司采购人员在购买药用辅料丙二醇(结构简式为HOCH2CH2CH2OH)时,为图便宜,购入了假冒丙二醇的二甘醇(结构简式为HOCH2CH2—O—CH2CH2OH)并作为辅料用于“亮菌甲素注射液”的生产,从而酿成多人死伤的惨剧。关于丙二醇与二甘醇的说法中正确的是( )。
| A.丙二醇与二甘醇互为同系物 |
| B.丙二醇和二甘醇都互为同分异构体 |
| C.1 mol丙二醇与二甘醇的混合物可以与足量金属钠反应生成11.2 L氢气 |
| D.丙二醇与二甘醇都能发生取代反应 |
反应4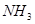 (g)+5
(g)+5 (g)
(g) 4NO(g)+6
4NO(g)+6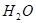 (g)在10L密闭容器中进行,
(g)在10L密闭容器中进行,
半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为()
A. (NH3)="0.0100" mol·L-1·S-1 (NH3)="0.0100" mol·L-1·S-1 |
B. (O2)="0.0010" mol·L-1·S-1 (O2)="0.0010" mol·L-1·S-1 |
C. (NO)="0.0010" mol·L-1·S-1 (NO)="0.0010" mol·L-1·S-1 |
D. (H2O)="0.045" mol·L-1·S-1 (H2O)="0.045" mol·L-1·S-1 |
在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的。在有关上述工艺流程的以下化学用语中,错误的是
A.用电子式表示氢溴酸的形成过程为: |
B.海水中Br-的电子式为: |
| C.海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2= Br2+2Cl- |
D.Cl-的结构示意图为: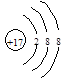 |