已知15.6gNa2X固体中含有0.4molNa+。
(1)X的相对原子质量为 ,如果X原子中质子数和中子数相等,则X是 元素(填元素名称)。
(2)将39gNa2X固体溶解到水中,并加水稀释至2L。此时溶液中Na+的物质的量浓度为 ,从中取出100mL溶液,此时溶液中Na+的物质的量浓度为 ,则其中所含Na+的数目是 。
(6分)在下列物质
| A.:烧碱, | B.NH3.H2O, |
| C.SO3, | D.铁片,(E)食盐水,(F)甲烷, |
(G)醋酸,(H)碳酸钙中,
属于电解质的是____________,属于非电解质的是________________;
既不属于电解质又不属于非电解质___________ 。
根据图示回答下列问题:
(1)A、F 中所含官能团的名称分别是。
(2)反应②的条件是。反应②的反应类型为。
(3)反应③的化学方程式是。反应③的反应类型为。
(4)写出D的键线式 。
。
(5)F在铜催化下与氧气反应的化学方程式是。
 某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。 (1)A的分子式为
(1)A的分子式为 ,A分子中最多在同一平面的原子数为;
,A分子中最多在同一平面的原子数为; (2)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%
(2)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7% ,写出此化合物的结构简式;
,写出此化合物的结构简式; (3)已知:
(3)已知: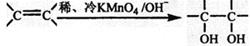 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式; (4)根据马氏规则:不对称加成时,通常“氢加到含氢多的不饱和碳原子一侧”,写出A与HBr反应主要产物B的结构简式;化合物B有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:。
(4)根据马氏规则:不对称加成时,通常“氢加到含氢多的不饱和碳原子一侧”,写出A与HBr反应主要产物B的结构简式;化合物B有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:。
①含苯环②苯环上只有两种不同化学环境的氢原子。
工程塑料ABS树脂结构为:
合成它用了三种单体,这三种单体的结构简式分别是________ 、________、________。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。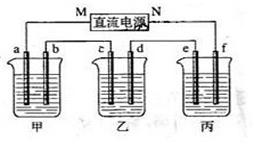
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
极;
②电极b上发生的电极反应为;
③计算电极b上生成的气体在标准状态下的体积:;
④电极c的质量变化是g;
⑤电解前后各溶液的PH大小是否发生变化(填变大、变小、不变):
甲溶液;乙溶液 ;丙溶液
;丙溶液
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?