 He 可以作为核聚变材料,下列关于
He 可以作为核聚变材料,下列关于 He的叙述正确的是( )
He的叙述正确的是( )
A. He 和 He 和 H 互为同位素 H 互为同位素 |
B. He 原子核内中子数为2 He 原子核内中子数为2 |
C. He 原子核外电子数为2 He 原子核外电子数为2 |
D. He 代表有2个质子和3个中子的氦原子 He 代表有2个质子和3个中子的氦原子 |
常温下,下列各组比值为1∶2的是 ()
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c (CH3COO-)之比 |
下图为两个原电池装置图,由此判断下列说法错误的是()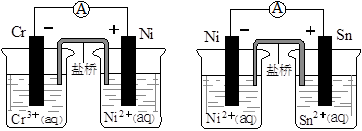
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
下列有关判断正确的是()
| A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+) |
| B.能使紫色石蕊试液呈红色的溶液:Na+、NH、I-、NO可以大量共存 |
| C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O |
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是()
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)=10.00 mL 时, <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl‾)>c(CH3COO—) |
常温下,在下列各组溶液中,加水稀释时c(H+)/c(OH-)明显增大,且能大量共存的离子组是( )
①K+、Cl-、NO3-、AlO2-
②K+、Fe2+、I-、SO42-
③Ba2+、OH-、NO3-、Na+
④Na+、Ca2+、Al3+、Cl-
| A.①② | B.①③ | C.②④ | D.②③ |