等质量的氧气和臭氧(O3),它们的物质的量之比为 ,标准状况下的体积比为 ,原子的个数比为 ,标准状况下的密度之比为 。
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g)ΔH <0达到平衡的标志是__________________________(填编号)
2NH3(g)ΔH <0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥碳化硅晶体;⑦溴化钠;⑧氖。请用编号填写下列空白:
A.属于原子晶体的是_____________,其中熔点由高到低的顺序为____________
B.属于分子晶体的是_____________________,其中分子构型为正四面体的化合物的电子式为_________________
C.既含有共价键又含有离子键的化合物是_______,其中阳离子个数与阴离子个数之比为_____
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 |
选项的标号 |
| 除去FeCl3溶液中的FeCl2 |
|
| 从碘水中提取碘单质 |
|
| 提纯混有少混NaCl的KNO3 |
|
| 鉴别NaCl和KCl |
供选择的化学试剂或实验方法如下:
A、加热灼烧,观察
B、在较高温度下溶于水配成浓溶液,再冷却结晶
C、加入四氯化碳萃取
D、加入适量的铁屑
E、通入Cl2气体
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3。操作讨程如下: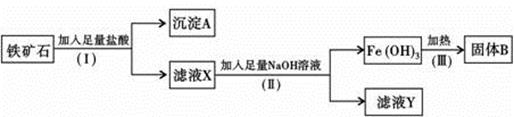
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是;
(2)沉淀A中主要含有,固体B是;
(3)取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成色,滤液Y中的阴离子除OH-、Cl-外,还有;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式
(12分)针对下面10种元素,完成以下各小题。
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
C |
N |
O |
Ne |
||||
| 3 |
Na |
Mg |
Al |
Si |
S |
Cl |
(1)常温下,会在浓硫酸中发生钝化的金属是(填名称)。
(2)化学性质最不活泼的元素是(填元素符号)。
(3)镁的原子结构示意图为。
(4)C与N相比,原子半径较小的是。
(5)最高价氧化物对应的水化物酸性最强的是碱性最强的是(填化学式)。
(6)常用于制半导体材料的元素是。
(7)H2S和HCl相比,热稳定性较强的是。
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式,其中硫元素和氧元素的质量比m(S): m(O)= 。
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:
氨在人类的生产和生活中有着广泛的应用
(1)下列含氮物质属于盐的是属于非电解质的是。
| A.NH3 |
| B.NH3•H2O |
| C.NH4NO3 |
| D.HNO3 |
E.N2
(2)0.1 mol的N2H4气体和0.2molNH3气体,它们在同温、同压下的体积比是,所含的原子数比是。
(3)氨气溶解于水,得到的溶液称为氨水。氨溶解于水时与水发生反应生成一水合氨(NH3·H2O),它是一种弱碱。写出一水合氨的电离方程式。从上述电离方程式可知,往氨水中加入稀硫酸生成的盐是(填化学式)
(4)标准状况下,将 2.24L的氨气溶于水配成 0.5L溶液,所得溶液的物质的量浓度为mol/L。
(5)氨可与Cl2反应,反应方程式如下:8NH3+3Cl2=6NH4Cl+N2,利用该反应的原理,在工业上可用于检验输送氯气的管道是否漏气。该反应中,__________是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为____________mol,被氧化的物质有mol。