下列实验过程中出现的异常情况,其可能原因分析错误的是
| 选项 |
异常情况 |
可能原因分析 |
| A |
蒸发结晶:蒸发皿破裂 |
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B |
分液:分液漏斗中的液体难以滴下 |
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C |
萃取:液体静置不分层 |
加入萃取剂的量较多 |
| D |
蒸馏:冷凝管破裂 |
冷凝管没有通水或先加热后通水 |
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
| A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42- |
| B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定有大量的CO32- |
| C.用洁净的铂丝蘸取该溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色。该溶液中一定含有钾离子,可能含有钠离子。 |
| D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl- |
已知有如下反应:①2BrO3-+Cl2==Br2+2ClO3-,②2FeCl2+Cl2==2FeCl3③ClO3-+5Cl-+6H+==3Cl2+3H2O,④2FeCl3+2KI==2FeCl2+2KCl+I2,下列各微粒氧化能力由强到弱的顺序正确的是 ( )
| A.ClO3- > BrO3- > Cl2 > Fe3+ > I2 | B.BrO3- > Cl 2> ClO3- > I2 > Fe3+ |
| C.BrO3- > ClO3- > Cl2 > Fe3+ > I2 | D.BrO3- > ClO3- > Fe3+ > Cl2 >I2 |
下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是:
①NaHCO3②Al2O3 ③Al(OH)3④Al⑤Na2CO3
| A.③④ | B.①②③④ | C.①③④ | D.全部 |
中学化学教材中,常借助于图像的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是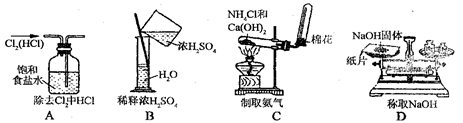
根据水泥和玻璃的生产,总结出硅酸盐工业的一般特点是:①生成物是硅酸盐;②反应条件是高温;③含有硅的物质作原料;④反应原理是一系列复杂的物理化学变化
| A.①③ | B.①②③ | C.①③④ | D.①②③④ |