将17.9 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生3.36 L。气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成6.72 L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为 ( )
A.33.2 g B.25.4 g C,22.4 g D.19.6 g
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是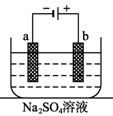
| A.a电极附近呈红色,b电极附近呈蓝色 |
| B.a电极附近呈蓝色,b电极附近呈红色 |
| C.逸出气体的体积,a电极的大于b电极的 |
| D.a、b两电极都逸出无色无味气体 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.拆开物质中的化学键一定需要吸收能量 |
| C.应用盖斯定律,无法计算某些难以直接测量的反应焓变 |
| D.化学反应都伴随着能量变化和其他各种现象的出现 |
下列物质的有关事实与电化学腐蚀无关的是
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀 |
| D.在空气中,金属镁、铝的表面可形成一层氧化膜 |
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
| A.水可以电离出离子,所以是强电解质 |
| B.水的离子积可表示KW=c(H+)·c(OH-) |
| C.常温下水中的c(H+)大于c(OH-) |
| D.升高温度,c(H+)增大,显弱酸性 |