某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见 化合物的性质。过程如下:
化合物的性质。过程如下:
【提出问题】
①在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(O H)3具有两性,Cu(OH)2也具有两性吗?
H)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③Cu0有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、 、 (填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80—100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,则A的化学式为 。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
实验中观察到Cu0变为红色物质。查资料可知,同时生成一种无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是 。
(2)根据实验方案(2),得出的+1价Cu相+2价Cu稳定性大小的结论是:在高温时 。在酸性溶液中 。
(3)CuO能够被NH3还原。
【问题讨论】
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
(每空2分,16分)生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_________。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________ (不用写反应条件),原子利用率是_________。
(3)下列属于乙醇的同系物的是_____,属于乙醇的同分异构体的是_____。(选填编号)
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗__________mol氧气。
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_____________。
③下列说法正确的是__________。(选填字母)
| A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应 |
| B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车 |
| C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 |
| D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯 |
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
B |
||||||
| D |
E |
F |
|||||
| C |
G |
H |
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式 _________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②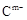 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)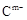 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:
_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:2混合,写出该反应的离子方程式。该溶液的溶质含有的化学键类型是
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为______________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是__________________________________,
用电子式表示化合物B的形成过程:_______________________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素
同周期,则反应①的化学方程式为___________________________________。
(3)同族非金属元素之间相互置换的一般是第ⅣA、第ⅥA、第ⅦA。
I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ |
元素编号 |
|||||
| ① |
② |
③ |
④ |
⑤ |
⑥ |
|
| 原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
| 最高化合价 |
+6 |
+5 |
+5 |
+7 |
||
| 最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________