向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是
| A.滴加KI溶液时,转移2mol e-时生成1mol白色沉淀 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
把1 g含脉石(SiO2)的黄铁矿样品放在O2流中灼烧,反应完全后得到残渣0.78 g,则此黄铁矿的纯度是…()
| A.33% | B.66% | C.78% | D.88% |
接触法制硫酸的生产过程中,下列措施能提高硫酸的产率的是()
| A.控制接触室内的温度在450℃左右 |
| B.沸腾炉中通入过量空气 |
| C.对炉气进行除尘、洗涤、干燥处理 |
| D.接触室中用V2O5作催化剂 |
在下列气体的制取中,均用到浓硫酸。浓硫酸只起脱水剂作用的是()
| A.浓硫酸与甲酸加热制取CO |
| B.浓硫酸与铜反应制取SO2 |
| C.浓硫酸与无水乙醇反应制取乙烯 |
| D.浓硫酸与亚硫酸钠反应制取SO2 |
在硫酸工业制法中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见下图)。按此密闭体系中气体的流向,则在A处流出的气体为()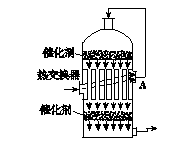
| A.SO2 | B.SO3O2 | C.SO2O2 | D.SO2SO3 |
下列关于三氧化硫的叙述正确的是()
| A.标准状况下三氧化硫是一种无色气体 |
| B.三氧化硫与水反应放出大量的热 |
| C.接触法制硫酸中常用水吸收三氧化硫 |
| D.三氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水 |