在①H2S ②SO2 ③CO ④Cl2 ⑤HCl 五种气体中,能使品红溶液褪色的是_______;通入石蕊试液先变红后褪色的是__________,只变红不褪色的是__________;能使碘化钾淀粉试纸变蓝的是__________;能与溴水反应的是__________。(填序号)
某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2)若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3)若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。
SO3(g)+NO(g)的ΔH=kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
若测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
水的电离平衡曲线如下图所示。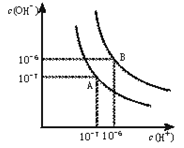
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为。
(4))25℃时,在等体积的① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
甲、乙两池电极材料都是铁棒与碳棒(如图)。请回答下列问题:
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒。
②在乙池中阳极的电极反应是_______________________________________。
(2)若两池中均盛放饱和NaCl溶液:
①写出乙池中总反应的离子方程式:_____________________________________。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。则该反应的化学方程式为。
(10分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法该法的工艺流程为:
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色。
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。
方法2:电解法该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为。
(5)在阴极附近溶液pH升高的原因是(结合电极反应式解释);
溶液中同时生成的沉淀还有