CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g); ΔH=-1160 kJ/mol
ΔH=-1160 kJ/mol
下列说法不正确的是
| A.反应①②均为放热反应 |
B.反应①②转移的电 子数相同 子数相同 |
C. 由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-a kJ/mol,a<574 由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-a kJ/mol,a<574 |
| D.若用标准状况下4.48 L CH4通过上述反应还原NO2至N2,放出的热量为173.4kJ |
人造象牙的主要结构是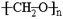 ,它是通过加聚反应制得,则合成人造象牙的单体是
,它是通过加聚反应制得,则合成人造象牙的单体是
| A.(CH3)2O | B.HCHO | C.CH3CHO | D.H2N-CH2-CO-NH2 |
下列有机物命名正确的是
| A.CH3(CH2)4CH3 1,4-二甲基丁烷 | B.CH3CH(CH3)CH=CH2甲基丁烯 |
| C.CH3CH2CH(CH3)2 2-甲基丁烷 | D.CH2ClCH2Cl二氯乙烷 |
1-溴丙烷和2-溴丙烷分别与NaOH的乙醇溶液共热,关于这两个反应的说法正确的
| A.产物相同,反应类型相同 | B.产物不同,反应类型不同 |
| C.碳氢键断裂的位置相同 | D.碳溴键断裂的位置相同 |
下列五种有机物:①甲烷②乙烯③乙炔④3-甲基戊烷⑤甲苯,某同学在分类时将①④⑤划为一类,②③划为一类。将①④⑤划为一类的依据是
| A.①④⑤均为烃类物质 |
| B.①④⑤均不能发生加成反应 |
| C.①④⑤在光照下均能与Cl2发生取代反应 |
| D.①④⑤均不能使酸性高锰酸钾溶液褪色 |
将等体积的苯、汽油和水在试管中充分混合后静置。下列图示现象正确的是


