下列关于电解质溶液的叙述正确的是:
| A.常温下,同浓度的Na2SO3与NaHSO3溶液相比,Na2SO3溶液的pH大 |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的 体积变化的图象如下所示,下列说法正确的是
体积变化的图象如下所示,下列说法正确的是
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ | |
| B.原溶液中一定含有SO42-和Na+ |
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
D.反应最后形成的溶液中含有的溶质为Na 2SO4 2SO4 |

.欲检验一瓶中装的是稀氨水,现用一沾有浓盐酸的玻棒靠近瓶口,为了使现象明显,可事先往瓶中加入下列哪种物质
①浓H2SO4 ②固体烧碱 ③固体P2O5 ④生石灰 ⑤固体NH4Cl ⑥固体食盐
| A.①② | B.②③④ | C.②④⑤ | D.①③⑥ |
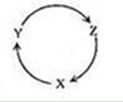
下列各组物质中,满足下图物质一步转化关系的选项是
| X |
Y |
Z |
|
| A |
Na |
NaOH |
NaHCO3 |
| B |
Cu |
CuSO4 |
Cu(OH)2 |
| C |
C |
CO |
CO2 |
| D |
Si |
SiO2 |
H2SiO3 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是K2CO3 |
| B |
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2 粉末,搅拌一段时间后过滤 |
除去MgCl2溶液中少量FeCl3 |
| C |
常温下,向饱和Na2CO3溶液中通入CO2气体,溶液中有固体析出 |
说明CO2可降低Na2CO3的溶解度 |
| D |
水蒸气通过足量Na2O2,产生的气体能使带火星的木条复燃 |
说明H2O具有还原性 |
下列叙述正确的是
| A.SO2具有还原性,故可作漂白剂 |
| B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |