1.92 g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
| A.504 mL | B.336 mL | C.224 mL | D.168 mL |
某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示: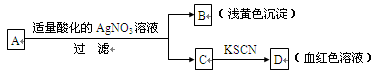
现对A、B、C、D作出的如下推断中,不正确的是
A.盐A一定是FeBr3 B.浅黄色沉淀B是AgBr
C.滤液C中一定含Fe3+ D.D溶液中有Fe(SCN)3
把11.5 g钠投入m1 g过量水中得到a g溶液,把12 g镁投入m2 g过量盐酸中,得到b g溶液,若m1=m2,a和b的质量关系是
| A.a>b | B.a<b | C.a=b | D.不确定 |
有100 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3 mol·L-1,欲使Mg2+完全转化为Mg(OH)2沉淀,且与Al3+恰好分离,至少需要2 mol·L-1的NaOH溶液的体积为
| A.80 mL | B.100 mL | C.120 mL | D.140 mL |
X、Y、Z、W有如图所示的转化关系,则X、W可能是①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2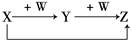
A.①②③ B.①② C.③④ D.①②③④