右图是某有机 分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。对该物质下列说法正确的是( )
分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。对该物质下列说法正确的是( )
| A.该物质的水溶液可除去水瓶胆中的水垢。 |
| B.该物质是室内装潢的夹板中散发出一种对人体有害气体。 |
| C.它与乙醇混合加热就能产生具有水果香味的物质 |
| D.该物质属电解质,在熔融状态下可导电。 |
对于反应A(g)+2B(g) 2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
密闭的烧瓶里盛放气体A,在25℃时建立平衡:2A(g) B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
| A.平均相对分子质量 | B.密度 | C.容器内的压强 | D.物质的量 |
在体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
| A.N2为0.2 mol·L-1,H2为0.6 mol·L-1 |
| B.N2为0.15 mol·L-1 |
| C.N2、H2均为0.18 mol·L-1 |
| D.NH3为0.4 mol·L-1 |
已知H2(g)+Br2(g) = 2HBr(g) ΔH=-72 kJ/mol,其他相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
366 |
则表中a为
A.404 B.368C.224 D.200
在25℃、101 kPa下,0.1 mol甲醇燃烧生成CO2和液态水时放热72.65 kJ,下列热化学方程式正确的是
A.CH3OH (l)+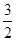 O2 (g) = CO2(g)+2H2O(l) ΔH=+726.5 kJ/mol O2 (g) = CO2(g)+2H2O(l) ΔH=+726.5 kJ/mol |
| B.2CH3OH (l)+3O2 (g) = 2CO2(g)+4H2O(g) ΔH=+1453 kJ/mol |
C.CH3OH (l)+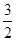 O2 (g) = CO2(g)+2H2O(l) ΔH=-726.5 kJ/mol O2 (g) = CO2(g)+2H2O(l) ΔH=-726.5 kJ/mol |
| D.2CH3OH (l)+3O2 (g) = 2CO2(g)+4H2O(g) ΔH=-1453 kJ/mol |