可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒 ▲
(2)除去NaCl晶体中混有的碘单质 ▲
(3)分离石油中各不同沸点范围的成分 ▲
(4)分离水和苯的混合物 ▲
(1)化学与人类生产、生活密切相关。请按要求回答下列问题:
①下列我国古代的技术应用中,其工作原理不涉及化学反应的是 (填字母)
| A.火药使用 |
B.粮食酿酒 |
C.转轮排字 |
D.铁的冶炼 |
 |
 |
 |
 |
②下列用品的有效成分及用途对应错误的是 (填字母)
| A |
B |
C |
D |
|
| 用品 |
 |
 |
 |
 |
| 有效成分 |
NaCl |
NaOH |
NaHCO3 |
Ca(ClO)2 |
| 用途 |
做调味品 |
做治疗胃病的抗酸药 |
做发酵粉 |
做消毒剂 |
③工业上常用氯气和石灰乳反应生产漂白粉,其原理是_________________(用化学方程式表示)。
④在生产中,人们曾用浓氨水来检验氯气管道是否漏气。如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为____________。
(2)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。物质分类及转化思想贯穿整个化学科学习的始终。
①有下列十种物质:
A.空气 B.O2 C.NaHSO4 D.氨水 E.CuSO4·5H2O F.NaOH
G.CO2 H.Fe2O3 I.金刚石 J.H2SO4
其中属于混合物的有 ;属于单质的有 ;属于盐的有 。(填字母)
②有下列六个反应:
A.Cl2+H2O = HCl+HClO
B.Zn + H2SO4 = ZnSO4 + H2↑
C.2Cu2O + Cu2S  6Cu+SO2↑
6Cu+SO2↑
D.Cl2+2KI = 2KCl+I2
E.H2 + Cl2 2HCl
2HCl
F.2KClO3  2KCl+3O2↑
2KCl+3O2↑
其中属于置换反应的是 ,既属于分解反应又属于氧化还原反应的是 (填字母)。
③K2FeO4是一种重要的净水剂,可用下列方法制得:
2Fe(OH)3+3Cl2+10KOH 2K2FeO4+6KCl+8H2O
2K2FeO4+6KCl+8H2O
在该反应中,还原剂是 ,当反应中有1mol K2FeO4生成时,转移电子的数目为 。
(3)物质的量是化学计算的核心。请按要求完成下列填空:
①已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是 。
②含0.4 mol Al3+的Al2O3的质量是 。
③某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl—,则该光卤石的物质的量为 。
④标准状况下,224mL的氨气中含有的氢原子数为 。
Ⅰ.某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z = ;
②x、y、z应满足的一般条件是 。
(2)恒定温度、压强
①若x = 0,y = 0,则z 为 ;
②x、y、z应满足的一般条件是 。
Ⅱ.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为: n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平= 。 (用含a、b的代数式表示)
在T℃下,某Ba(OH)2稀溶液中c(H+)=10-a mol/L,c(OH—)=10-b mol/L,已知a+b=12,向该溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=
(2)x= 原Ba(OH)2稀溶液的物质的浓度为
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2稀溶液时,沉淀正好达到最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为 ,Na2SO4的物质的量浓度为
工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。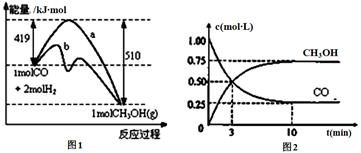
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)下列说法正确的是
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)= ;达到平衡时,c(H2)= ,该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数表达式为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数表达式为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol, 又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
工业制硫酸生产流程如下图:
催化室的反应为:2SO2+O2 2SO3△H<0
2SO3△H<0
(1)在沸腾炉中,需要将黄铁矿粉碎的目的是 。
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 。(填写编号)
a.减少压强 b.升高温度 c.不断补充空气 d.及时分离出SO3
(3)在450℃、常压和钒催化条件下,在容积为VL的恒容容器中加入2n molSO2和n molO2
判断反应达到平衡状态的标志是 。(填写编号)
a.SO2和SO3浓度相等b.SO2百分含量保持不变
c.容器中气体的压强不变d.SO3的生成速率与SO2的消耗速率相等
(4)图1、2表示该SO2和O2的反应在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况:
① 图1中时刻t2发生改变的条件是 。
② 图2中时刻t2发生改变的条件是 。