已知NaHCO3溶液和NaOH溶液反应的离子方程式为:HCO3-+OH-=CO32-+H2O,NaHCO3在水中的电离方程式为:NaHCO3= Na++HCO3-,下列离子方程式不正确的是( )
| A.硝酸银溶液与铜:Cu+2Ag+=Cu2++2Ag |
| B.Ba(HCO3)2溶液和硫酸混合:Ba2++ SO42-+2H+ +2HCO3-=BaSO4↓+ 2H2O+2CO2↑ |
| C.氧化铜与盐酸反应:O2-+2H+=H2O |
| D.Cu(OH)2加入H2SO4:2H++Cu(OH)2 = Cu2+ +2H2O |
在密闭容器中加入NaHCO3和NaOH的混合物共18.4g,加热至250℃,经充分反应后排出气体,冷却得到剩余固体质量为16.6g,通过计算可知原固体混合物中NaHCO3的质量为()
| A.12.6g | B.8.4g | C.10.2g | D.6.8g |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
1000 |
1500 |
| C(N2O5)/mol/L |
0.50 |
0.35 |
0.25 |
0.25 |
下列说法中错误的是()
A.500s时O2的浓度为0.075mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000s时将容器的体积缩小一半,重新达到平衡时0.25mol/L<c(N2O5)<0.50mol/L
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是()
| A.中间室Cl—移向左室 |
| B.X气体为CO2 |
| C.处理后的含硝酸根废水pH降低 |
| D.电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L |
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断错误的是()
A. 若A的单质,B和D的反应是OH-+HCO3-="=" H2O+CO32-,则E是一种清洁的能源
B. 若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
C. 若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
D.若X是Na2CO3,C为含极性键的分子,则A一定是氯气,且D和E能发生反应
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构如图所示,已知断裂1molN—N键吸收167kJ热量,生成1molN≡N键放出 942kJ热量。根据以上信息和数据,则1molN4(g)生成N2(g)的ΔH为()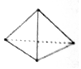
| A.-882kJ/mol | B.+441kJ/mol | C.+882kJ/mol | D.-441kJ/mol |