设NA为阿伏加德罗常数的数值,下列叙述中正确的是
| A.3.4gNH3中含有电子数为0.2NA |
| B.标准状况下,22.4 L Cl2参加所有化学反应转移的电子数一定都是2NA |
| C.标准状况下,0.5NA个SO3分子所占的体积约为11.2 L |
D.在18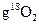 中含有 中含有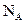 个氧原子 个氧原子 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是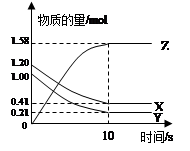
A.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
| D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
下列说法正确的是
| A.蓄电池充电时其负极应与外电源的的正极相连接 |
| B.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同 |
C.已知:H2(g)+I2(g)  2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 |
| D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1 |
在一密闭容器中,反应aA(g) bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.化学计量数关系:a>b |
化学反应C(s)+H2O(g) CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
| A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.加入固体碳,平衡向正反应方向移动 |
| C.加入水蒸气使容器压强增大,平衡向逆反应方向移动动 |
| D.减小压强,平衡向正反应方向移 |
下列事实,不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D.实验室用排饱和食盐水而不用排水法收集氯气 |