下列说法或表示方法正确的是
| A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
| B.氢气的燃烧热为285.8kJ · mol-1,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(g)△H=-285.8 kJ· mol-1 |
| C.吸热反应都需加热才能完成 |
| D.热化学方程式的化学计量数只表示物质的量,不表示物质的分子数或原子数 |
下列说法不正确的是
| A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
| B.纤维素、淀粉、油脂均为天然高分子物质 |
| C.通过红外光谱分析可以区分乙醇与乙酸乙酯 |
| D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
某温度T1时,向容积为2 L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g) 2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):
2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min |
n(H2)/mol |
n(I2)/mol |
| 0 |
0.9 |
0.3 |
| t1 |
0.8 |
|
| t2 |
0.2 |
下列说法正确的是
A.反应在t1 min内的平均速率为:v(H2)=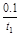 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C.保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol
D.升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
B.某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c (OH-)>c(H+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
D.25 ℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
设NA代表阿伏加德罗常数的数值,下列说法正确的是
| A.12.4 g白磷中含有共价键数为0.4 NA |
B.3Fe+4H2O(g)  Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 |
| C.在1 L 0.1 mol/L碳酸钠溶液中阴离子总数等于0.1 NA |
| D.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
常温下,下列各组离子在给定溶液中一定能大量共存的是
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl- |
| C.与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3- |
| D.由水电离出来的c(H+)=1.0×10-13 mol·L-1的溶液:K+、Na+、NO3-、Cl- |