下列化学方程式中,不能用H++OH-=H2O表示的是
| A.2NaOH+H2SO4=Na2SO4+2H2O |
| B.Ba(OH)2+2HCl=BaCl2+2H2O |
| C.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O |
| D.KOH+HCl=KCl+H2O |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)  NH
NH +NH
+NH ,
,
NH 的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
| A.在液氨中加入NaNH2,可使液氨的离子积变大 |
| B.在液氨中加入NH4Cl,液氨的离子积不变 |
| C.此温度下液氨的离子积K为1×10-30 |
| D.在液氨中加入金属钠可能有NaNH2生成 |
已知C(s)+CO2(g) ="=" 2CO(g) △H>0,反应速率为 ,
,
Zn(s)+2HCl(aq)== ZnCl2 (aq)+H2(g)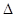 H<0,反应速率为
H<0,反应速率为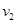 ,
,
对于上述反应,当温度升高时, 和
和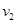 的变化情况为
的变化情况为
| A.同时增大 | B.同时减小 |
C. 增大 增大 减小 减小 |
D. 减小 减小 增大 增大 |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g)  2SO3(g) ΔH<0 2SO3(g) ΔH<0 |
B.4 NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
C.H2(g)+I2(g)  2HI(g) ΔH>0 2HI(g) ΔH>0 |
D.2 NH3(g) N2(g) +3H2(g) ΔH>0 N2(g) +3H2(g) ΔH>0 |
已知:HCN(aq)+ NaOH(aq) ==NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq) ==NaCl (aq)+H2O(l) ΔH=-55.6 kJ·mol-1
则HCN在水溶液中电离的ΔH等于
| A.+43.5 kJ·mol-1 | B.+67.7 kJ·mol-1 |
| C.-43.5 kJ·mol-1 | D.-67.7 kJ·mol-1 |