下列有关实验的叙述,正确的是(填序号)
| A.用98%的浓硫酸配制100g10%的稀硫酸溶液时,除使用量筒外还需用到容量瓶 |
| B.用渗析法分离淀粉中混有的NaNO3杂质 |
| C.无法用分液漏斗将乙二醇和水的混合液体分离 |
| D.用浓氨水洗涤做过银镜反应的试管 |
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅
拌
F.用酸式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液
G.用托盘天平称取10.50g干燥的NaCl固体
H.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
I.用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物
J.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀
刚好溶解为止
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是
;调溶液pH的目的是使生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用cmol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(16分)某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性.回答下列问题.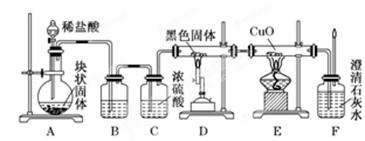
(1)写出装置A中所发生反应的离子方程式____________________________________.
(2) B中最适宜的试剂是__________________________________________________.
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:________________________________________.
(4)装置D中黑色固体为________(填名称),反应的化学方程式为________________.
(5)按照如图装置进行实验时,首先进行的操作是_______________________.
(6)根据实验中的______________________现象,可证明CO具有还原性,有关反应的化学方程式是____________________________________.
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的________装置(填序号).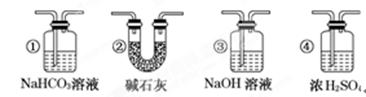
某同学称取了4.0 gNaOH固体,欲配制100 mL溶液。回答下列问题:
(1)该实验中,用到的能确定体积的两种玻璃仪器是________、________。
(2)操作过程中多次用到玻璃棒,其在实验中的作用有_____。
(3)不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响(填“偏大”、“偏小”或“不变”):
①在溶解过程中有少量液体溅出烧杯外________;
②定容时仰视仪器上的刻度线________;
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线________。
(4)最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如图)。
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为
(2)两同学利用下图所示装置进行测定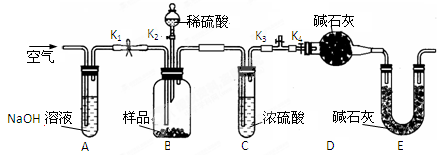
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为、洗涤、干燥。
②装置E中碱石灰的作用是。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同)。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为。
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。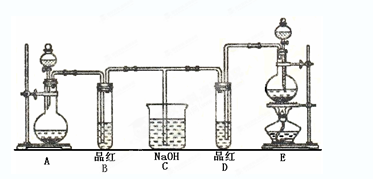
(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中装置(填装置序号)制Cl2。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B: ,D: 。
(3) 装置C的作用是 。
(4) 甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析: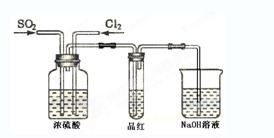
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ,并写出其相应的离子方程式: 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: 。