(12分) 已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下 表。
表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外 共有 种不同运动状态的电子,有 种不同能级的电子。
共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化 物中,沸点由高到低
物中,沸点由高到低 的排列次序依次为(写化学式) 。
的排列次序依次为(写化学式) 。
(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]C l3 B.[R(H2O)5Cl]Cl2·H2O
l3 B.[R(H2O)5Cl]Cl2·H2O
C. [R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不 污染环境,其反应的化学方程式为 。
污染环境,其反应的化学方程式为 。
A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态。其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关的转化关系如下图所示(反应条件均已略去)。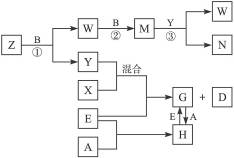
完成下列问题:
(1)Z分子的空间构型为_________。
(2)反应③中被氧化的物质与被还原物质的物质的量之比为_________。
(3)Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为_________g。
(5)将Z与N反应后的产物溶于水中,则溶液的pH_________(填“<”或“>”)7,其原因是(用离子方程式表示)_________________。
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体的许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学研究的热点,NO亦被称为“明星分子”。请完成下列问题。
(1)NO对环境的危害在于____________(填以下项目的编号)。
| A.破坏臭氧层 | B.高温下能使一些金属被氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式_____________________________________________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50 ℃,发现气体的压力迅速下降,压力降至略小于原压力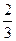 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_______________________________________________________。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_______________________________________________________。
“神舟”5号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼〔(CH3)2N—NH2〕,氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。
pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
(1)写出正盐的化学式:______________________________。
(2)若该盐中只有一种离子水解,该离子水解的离子方程式为_________________________。
(3)简述该混合液呈碱性的原因。
BiCl3水解产物中有BiOCl生成。
(1)写出水解反应方程式______________________。
(2)医药上将BiOCl称为次氯酸铋,该名称____________(填“正确”“不正确”)。
(3)如何配制BiCl3溶液?