将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是
A B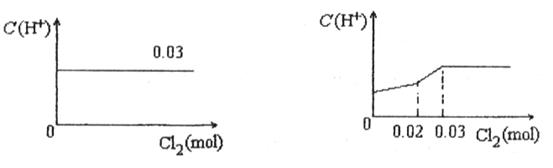
C D
图1和图2是A、B两种物质的核磁共振氢谱。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式
A.A是C3H6、B是C2H6B.A是C6H6、B是C4H6
C.A是C6H6、B是C2H6D.A是C3H8、B是C6H6
常温下,体积相同、pH也相同的HCl、HNO3、CH3COOH溶液分别与足量的NaHCO3溶液反应,产生CO2的体积
| A.同样多 | B.HCl最多 |
| C.HCl、HNO3一样多 | D.CH3COOH最少 |
下列有机物命名正确的是
| A.3,4,4—三甲基—1—戊炔 | B.2,2—二甲基—3—丁烯 |
| C.2,3,4,4—四甲基戊烷 | D.1,3,4—三甲基苯 |
能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)< c(H+)的操作是
| A.向水中投入一小块金属钠 | B.将水加热煮沸 |
| C.向水中通入二氧化碳气体 | D.向水中加醋酸钠晶体 |
下列各物质中,存在顺反异构体的是
| A.1—丁烯 | B.丙烯 |
| C.2—氯—2—丁烯 | D.2—甲基—2—丁烯 |