常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4-====2X2++5Z2+8H2O;
②2A2++B2====2A3++2B-;
③2B-+Z2====B2+2Z-。
由此判断下列说法错误的是
| A.反应Z2+2A2+====2A3++2Z-可以进行 |
| B.Z元素在①③反应中均被还原 |
| C.氧化性强到弱的顺序是XO4->Z2>B2>A3+ |
| D.还原性由强到弱的顺序是A2+>B->Z->X2+ |
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
| A.X的非金属性比Y的强 |
| B.Y的原子半径比Z的原子半径大 |
| C.Z的最高价氧化物的水化物为强酸 |
| D.W的单质可与Y的氢化物生成两种强酸 |
下列说法不正确的是
| A.H2S、H2O、HF的热稳定性依次增强 |
| B.NAOH、KOH、Mg(OH)2的碱性依次减弱 |
| C.在过渡元素中寻找优良的催化剂 |
| D.在周期表中金属元素与非金属元素交界处寻找半导体材料 |
A、B两元素可形成AB型化合物,如果A、B两种离子的核外电子数之和为20 ,则A、B两元素所处的周期可能为
A.两种都在在同一周期 B.一种在第一周期,一种在第二周期
C.一种在第二周期,一种在第三周期 D.一种在第三周期,一种在第四周期
下列说法正确的是
| A.稀有气体元素最外层电子数均为8个 |
| B.原子最外层少于4个电子的元素均是金属元素 |
| C.相同条件下,H2O的沸点比H2S高是因为水分子间含有氢键 |
| D.目前人们已发现了5000多种核素,说明发现了5000多种元素 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是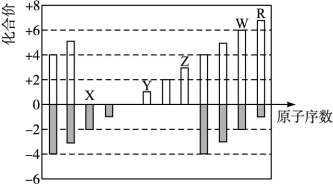
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R<W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |