ClO2是一种杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3 +H2C2O4 + H2SO4==2ClO2↑+ K2SO4 +2CO2↑+2H2O,下列说法正确的是
| A.KClO3在反应中得到电子 | B.1mol KClO3参加反应有2mol电子转移 |
| C.ClO2是氧化产物 | D.H2C2O4在反应中被氧化 |
在密闭容器中,反应X2(g)+Y2(g)  2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是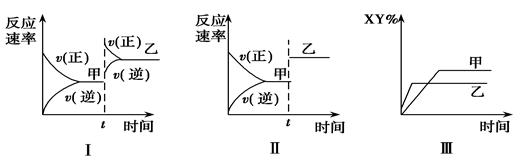
| A.图Ⅰ是增大压强的变化情况 |
| B.图Ⅱ一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强或升高温度的变化情况 |
| D.图Ⅲ是升高温度的变化情况 |
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 
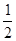 N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)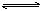 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
A.反应前2 min的平均速率v(Z)= 2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
下列可逆反应达平衡状态后,降温可以使混和气体平均相对分子质量减小的是
A.H2(气)+Br2(气)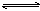 2HBr(气) (正反应为放热反应) 2HBr(气) (正反应为放热反应) |
B.N2(气)+3H2(气)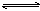 2NH3(气) (正反应为放热反应) 2NH3(气) (正反应为放热反应) |
C.2SO3(气)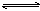 2SO2(气)+O2(气) (正反应为吸热反应) 2SO2(气)+O2(气) (正反应为吸热反应) |
D.4NH3(气)+5O2(气)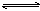 4NO(气)+6H2O(气) (正反应为放热反应) 4NO(气)+6H2O(气) (正反应为放热反应) |
已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.3mol,使其在O2中完全燃烧,共放出87.71kJ的热量,则炭粉与H2的物质的量之比是
| A.1︰1 | B.1︰2 | C.2︰3 | D.3︰2 |