根据已知条件,对物质的性质强弱判断不正确的是
A.已知 ,说明非金属性:碳>硅 ,说明非金属性:碳>硅 |
B.已知相同条件下气态氢化物的稳定性 ,说明还原性: ,说明还原性: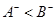 |
C.已知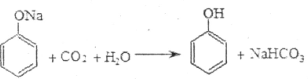 ,说明酸性:碳酸>苯酚 ,说明酸性:碳酸>苯酚 |
D.已知相同物质的量浓度的 两溶液中 两溶液中 ,说明碱性: ,说明碱性: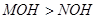 |
下列离子方程式正确的是
| A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH+NH4+ |
B.乙酸与碳酸钠溶液反应:2CH3COOH+CO32— CO2↑+H2O+2CH3COO— CO2↑+H2O+2CH3COO— |
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O— 2C6H5OH + 2CO32— 2C6H5OH + 2CO32— |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- = 5SO42- + 2Mn2+ +3H2O |
利用下图所示的有机物X可生产S-诱抗素Y。下列说法不正确的是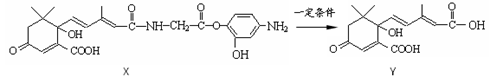
| A.由X生成Y的反应为取代反应 |
| B.X可以发生氧化、取代、酯化、加聚、缩聚反应 |
| C.Y可以与FeCl3溶液发生显色反应 |
| D.1 molY最多能和4 molH2发生加成反应 |
某烃结构简式如图: -C≡C-CH=CH-CH3,有关其结构说法正确的是
-C≡C-CH=CH-CH3,有关其结构说法正确的是
| A.所有原子可能在同一平面上 | B.所有原子可能在同一条直线上 |
| C.所有碳原子可能在同一平面上 | D.所有氢原子可能在同一平面上 |
有机物①C2H6 ②C2H4 ③C2H2 ④C6H6它们分子中的碳碳键键长由大到小排列顺序正确的是
| A.①>②>③>④ | B.①>④>②>③ |
| C.④>②>①>③ | D.④>①>②>③ |
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
| A.电解时以精铜作阳极 |
B.电 解时阴极发生还原反应 解时阴极发生还原反应 |
| C.粗铜连接电源负极,其电极反应是Cu—2e—=Cu2+ |
| D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |