下列判断 不正确的是
不正确的是
| A.沸点:HF>HCl>HBr | B.熔点:I2>H2O>H2S |
| C.酸性:HClO4>H2SO4>H2CO3 | D.离子半径:S2->F->Na+ |
下列说法正确的是
| A.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| B.向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变 |
| C.向氯水中加入Na2CO3可使溶液中c(HClO)增大 |
| D.室温下,将浓度为0.1 mol·L-1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变 |
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑
② 
③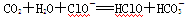
④ ,
,
由此得出的如下结论中不正确的是
A.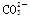 与H+、Ca2+不能大量共存 与H+、Ca2+不能大量共存 |
| B.H2CO3的酸性比HClO强,比H2SO3弱 |
| C.H2SO3是一种强酸 |
| D.H2CO3、HClO都属于弱酸 |
下列溶液一定呈中性的是
| A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| B.pH=7的溶液 |
| C.滴入酚酞显无色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
短周期主族元素A,B,C,D,E的原子序数依次增大,其中只有C为金属元素,B是地壳中含量最多的元素,C原子的最外层电子数和A相等;C,D两元素原子的质子数之和是A,B两元素质子数之和的3倍,下列叙述正确的是
A.元素的原子半径:A<B<C<D<E
B.对应氢化物的热稳定性:D>E
C.B与C、B与D形成的化合物中化学键类型相同
D.5种元素中最高价氧化物对应的水化物酸性最强的是E
下列有关说法中不正确的是
| A.铁与Cl2、盐酸均能发生反应,但生成的含铁物质组成不同 |
| B.分别加热蒸干并灼烧铁、铝的氯化物溶液,最后得到的物质均为金属氧化物 |
| C.等物质的量的Na、Cu、Al与足量氯气反应时,消耗的氯气一样多 |
| D.常温下,铁片、铝片与浓硫酸的反应均只能停留在金属的表面上 |