如图所示的实验中,能达到实验目的的是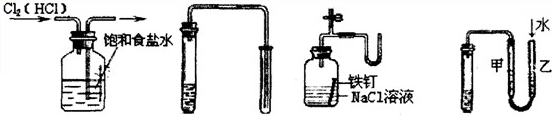
①除去Cl2中的 ②用铜和稀硝酸 ③证明铁生锈时空气 ④检验装置气密性
HCl杂质 制取少量NO 参与反应
| A.①②③④ | B.②③④ | C.③④ | D.①④ |
在密闭容器中进行如下反应:X2(g)+Y2(g)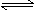 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A.Z为0.3 mol/L | B.Y2为0.4 mol/L |
| C.X2为0.2 mol/L | D.Z为0.4 mol/L |
已知298 K时,合成氨反应N2(g)+3H2(g)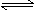 2NH3(g)ΔH=-92.0 kJ·mol-1,将此
2NH3(g)ΔH=-92.0 kJ·mol-1,将此
温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反
应放出的热量为(假定测量过程中没有能量损失) ( )
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
某温度下,反应2N2O5 4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
| A.v(N2O5)=1.8×10-4 mol/(L·s) | B.v(N2O5)=1.08×10-2 mol/(L·s) |
| C.v(NO2)=1.8×10-4 mol/(L·s) | D.v(O2)=1.8×10-4 mol/(L·s) |
下列各说法中,正确的是 ( )
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是
| A.生成物浓度一定增大 | B.生成物的物质的量分数一定增大 |
| C.反应物的转化率一定增大 | D.某生成物的产率可能提高 |