右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
据此下列说法正确的是 ( )
| A.该硫酸试剂可以做干燥剂,干燥任何气体 |
| B.该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| C.常温下,2.7gAl与足量的稀硫酸反应得到H2 3.36L |
| D.配制200mL 4.6mol·L-1的稀硫酸需取该硫酸50.0mL |
25 ℃、101 kPa下:①2Na(s)+O2 (g)===Na2O(s) ;ΔH1=-414 kJ/mol
②2Na(s)+O2 (g)===Na2O2 (s) ;ΔH2=-511 kJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25 ℃、101 kPa下,Na2O2 (s)+2Na(s)===2Na2O(s) ; ΔH=-317 kJ/mol |
根据下图,下列判断中正确的是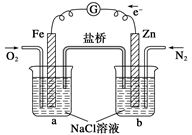
| A.烧杯a中的溶液pH升高 |
| B.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
| C.烧杯b中发生还原反应 |
| D.烧杯b中发生的反应为2Cl--2e-=Cl2↑ |
反应Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数
为2.15。下列说法正确的是
| A.升高温度该反应的正反应速率增大,逆反应速率减小 |
B.该反应的化学平衡常数表达式为K= |
| C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 |
| D.该反应的正反应是放热反应 |
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
| A.C(s)+1/2O2(g)=CO(g);ΔH=-110.5kJ·mol-1(燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g);ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O;ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);ΔH=-114.6 kJ·mol-1(中和热) |
下列过程属于熵(S)增加的是
| A.一定条件下,水由气态变成液态 |
| B.高温高压条件下使石墨转变成金刚石 |
| C.4NO2(g)+O2(g)=2N2O5 (g) |
| D.CaCO3(s)=CaO(s)+CO2(g) |