Ba2+是一种重金属离子,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL 0.100mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要 。。
(2)需准确称取Na2S2O3固体的质量为 g
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。有关的离子方程式为:
①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O
②I2+2S2O32- 2I-+S4O62-
试计算该工厂废水中Ba2+的物质的量浓度。
常温下电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)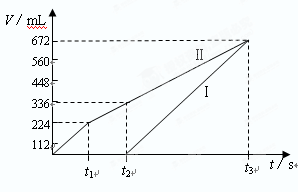
⑴图中曲线________(填Ⅰ或Ⅱ)表示阳极产生气体的变化;
⑵求NaCl和CuSO4的物质的量浓度;
⑶求t2时所得溶液的H+的物质的量浓度。
⑴某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+, Mg2+的物质的量浓度为多少?
⑵在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则KCl与CaCl2的物质的量之比为________,该混合物中的CaCl2的质量分数为多少?.
(8分) 实验室加热氯酸钾和二氧化锰的混合物制取氧气。若收集到标准状况下3.36 L氧气,至少需要多少克氯酸钾?生成氯化钾的物质的量为多少?(要求写计算步骤)
.(4分)已知Na与H2O发生反应:2Na +2H2O ="2NaOH" +H2↑,则4.6gNa溶于_________ g H2O中才能使溶液中Na+与H2O个数之比为1:10。
(4分)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是,氧气的质量是。